2021年5月13日,yd12300云顶线路李力/高维强课题组在国际自由基生物与医学学会和北美氧化还原生物与医学学会的官方杂志《Redox Biology》(IF:9.986)上在线发表了题为“The Histone Methyltransferase SETD2 Modulates Oxidative Stress to Attenuate Experimental Colitis”研究成果。该工作首次发现组蛋白甲基转移酶SETD2通过调控氧化应激反应来维持肠道上皮稳态并抑制结肠炎和结直肠癌(Colorectal cancer, CRC)的发生。
炎症性肠病(Inflammatory bowel disease, IBD)是一种慢性的且具有复发性的肠道炎症性疾病,包括克罗恩病(Crohn’s disease, CD)和溃疡性结肠炎(ulcerative colitis, UC)两种类型。近年来,IBD的发病率呈逐年上升趋势,而且持续的肠道炎症反应,还会有较高的概率发展成CRC。IBD的发病原因是多方面的,涉及遗传因素、环境因素、自身免疫系统以及肠道微生物群等各个方面。目前,IBD的具体发病机制尚不明确,针对性的诊疗手段也比较缺乏。而氧化应激反应是指机体在遭受各种有害刺激时,体内高活性分子如活性氧自由基(reactive?oxygen?species, ROS)产生过多,氧化程度超出氧化物的清除,氧化系统和抗氧化系统失衡,从而导致组织损伤。高维强/李力课题组2019年曾经报道,表观遗传调控因子BRG1通过调控自噬而在结肠炎症和肿瘤发生发展中发挥重要作用,并阐明了其在维持肠道稳态中的机制。(Liu et al, Nat Commun, 2019)。
SETD2是一种重要的表观遗传调控因子,具有组蛋白甲基转移酶活性。SETD2在具有发展为CRC高风险的溃疡性结肠炎样品中具有高达17%的突变率,这表明SETD2在IBD以及CRC中发挥着重要的作用。但是,截至目前,SETD2在IBD发生发展过程中的功能以及具体分子机制尚不明确。李力副研究员在2014年建立了Setd2条件性基因敲除小鼠模型并在生殖、发育和癌症等领域展开广泛的功能研究(Zuo et al, J Bio Chem, 2018; Wang et al, PLoS Biol, 2018; Xu et al, Nat Genet, 2019; Ji et al, Nat Commun, 2019; Niu et al, Gut, 2020; Li et al, Hepatology, 2020; Li et al, Cell Proliferat, 2021;Rao et al, Cancer Res, 2021)。在此基础上,李力/高维强课题组继续探究SETD2在IBD发生发展过程中的作用以及具体分子机制,以求寻找新的分子诊疗靶点。
研究人员利用IBD临床病人样品和基因敲除小鼠模型研究SETD2在IBD发生过程中的作用。首先,GEO数据库结果显示,SETD2在IBD(包括UC和CD)病人肠道组织中的表达水平显著低于正常肠道组织中的表达水平。利用IBD临床病人肠道组织样本进行SETD2的表达量分析发现,与正常组织相比,SETD2在IBD临床病人肠道组织中的表达水平显著降低。进一步研究发现,SETD2缺失的小鼠在DSS诱导的结肠炎中呈现出更严重的炎症表型,SETD2缺失可以引起小鼠肠道屏障损伤和肠道上皮细胞凋亡增加,进而加重肠道炎症反应以及随后的炎症性结肠癌的发生。
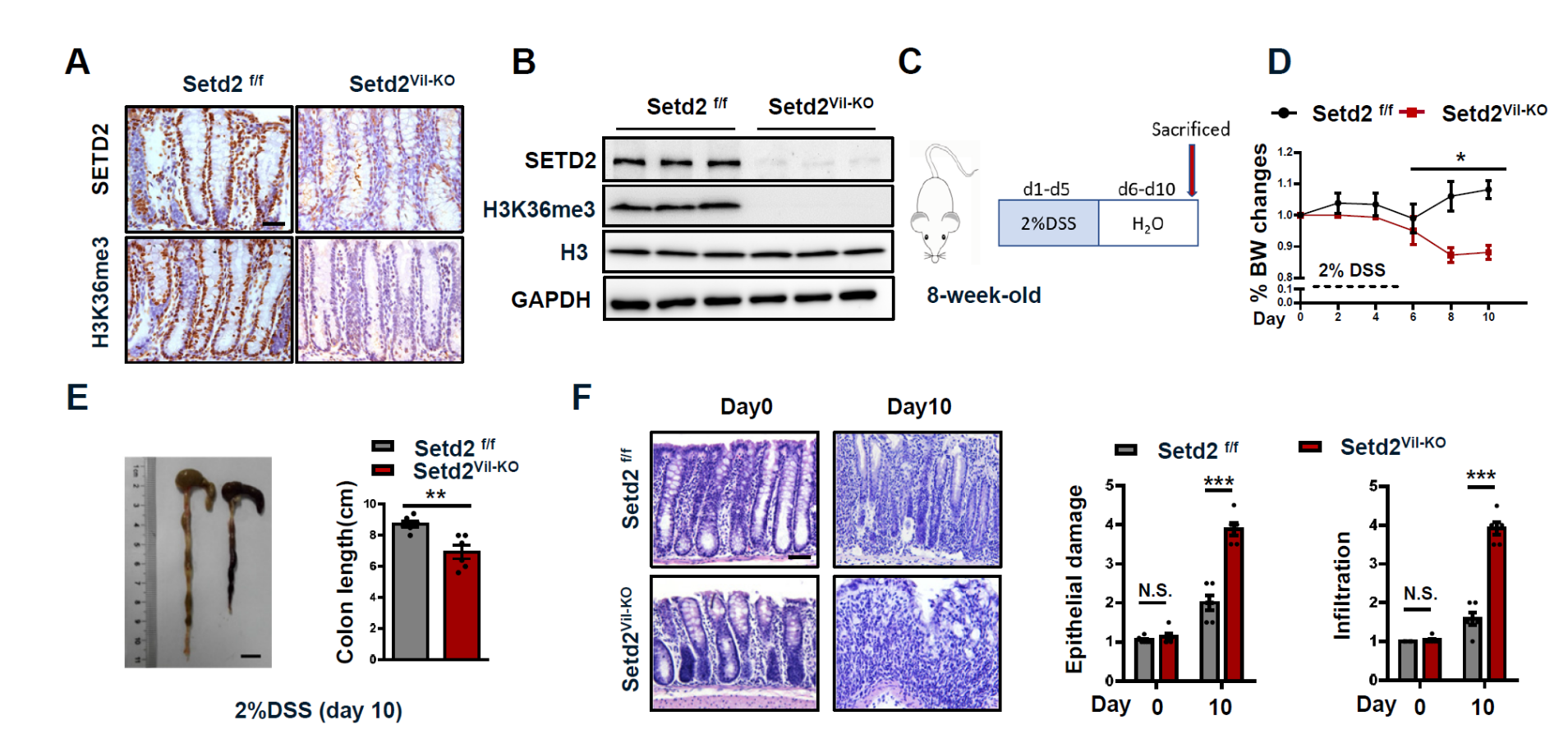
图1 SETD2缺失引起小鼠肠道屏障损伤,进而加重肠道炎症反应
通过RNA-Seq与ChIP-Seq进行分子机制分析发现,SETD2介导的H3K36me3可以通过直接促进抗氧化基因(Prdx3,Prdx6,Gclm和Srxn1等)的表达来降低ROS的水平,进而抑制肠道炎症反应。由此,研究人员利用一种抗氧化剂NAC(N-乙酰半胱氨酸)处理小鼠及其肠道类器官,或者在分离的肠道上皮细胞中过表达抗氧化基因Prdx6,均可以显著降低肠道上皮细胞里的ROS水平以及细胞凋亡水平,有效的抑制肠道炎症反应。
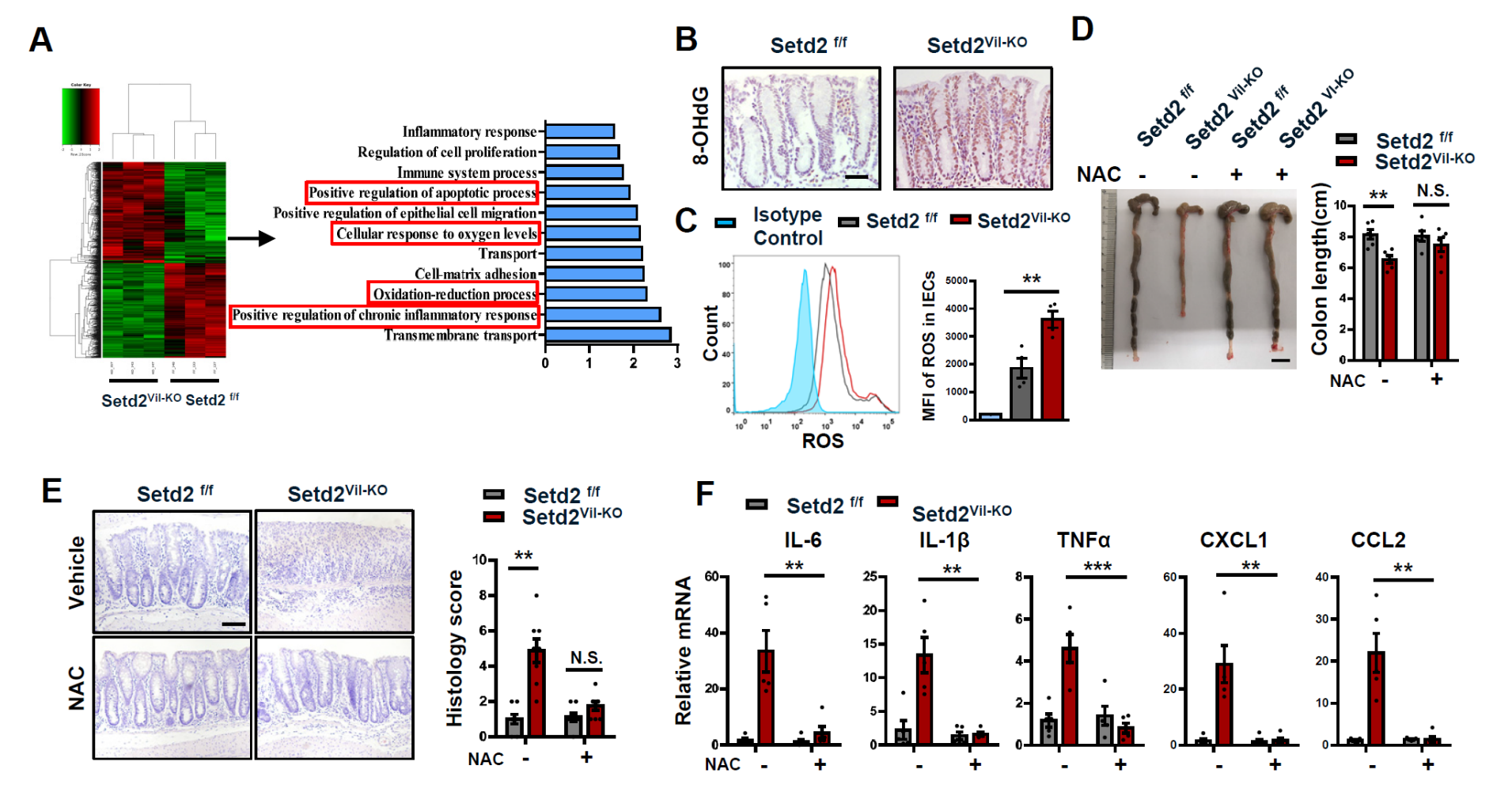
图2 SETD2调控ROS的水平,NAC可以挽救SETD2缺陷小鼠的IBD表型
该研究结果证明了组蛋白甲基转移酶SETD2在结肠炎症和肿瘤发生发展中的重要作用,并阐明了其在维持肠道稳态方面的分子作用机制。这些结果表明SETD2可以作为IBD干预的潜在治疗靶点,可以为与SETD2突变相关的IBD以及炎症性结肠癌的临床诊断和药物研发提供重要的理论依据。
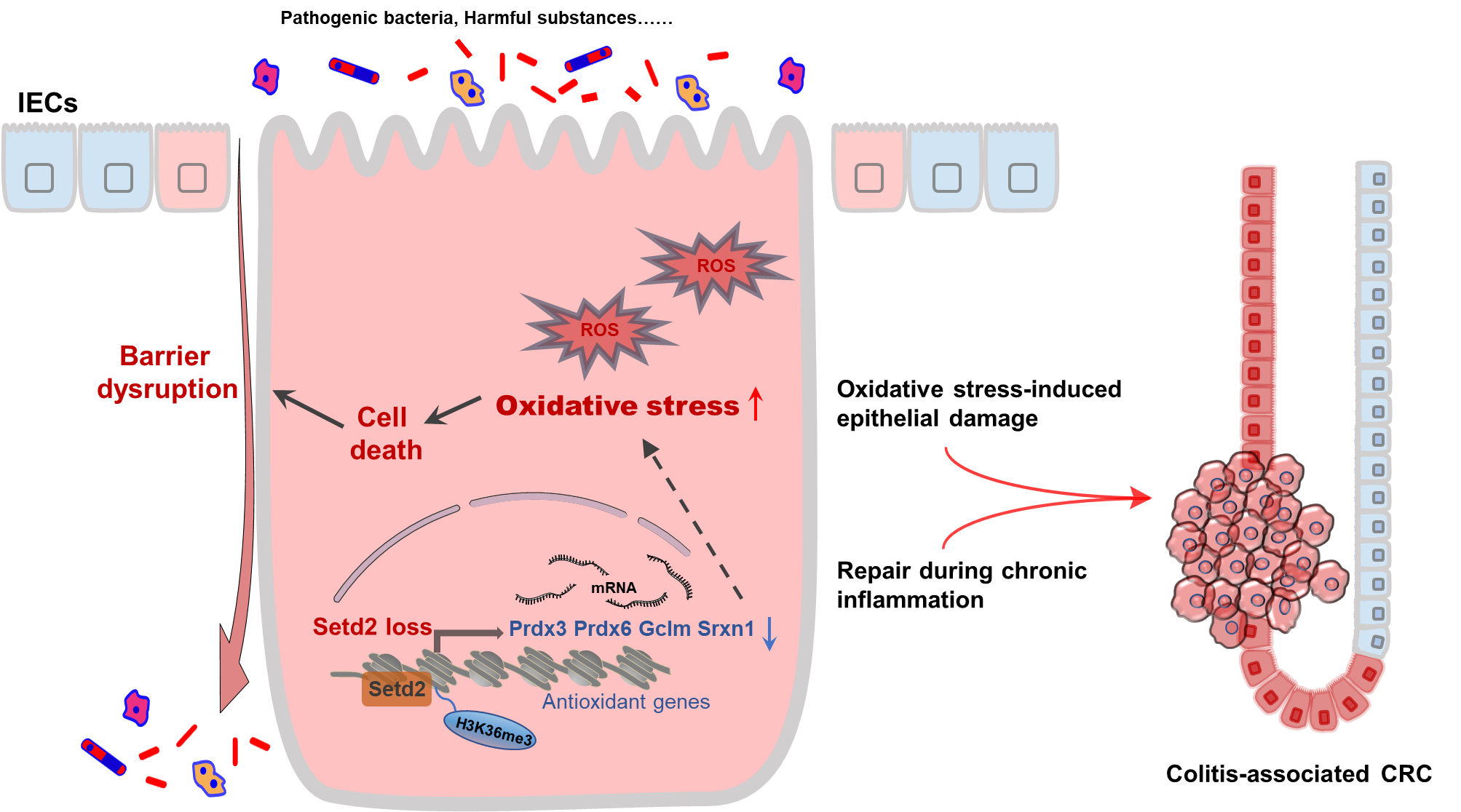
图3 SETD2通过调控氧化应激反应维持肠道上皮稳态并抑制结肠炎和结直肠癌的发生
yd12300云顶线路博士研究生刘敏为该论文的第一作者。李力副研究员和高维强教授为该论文的共同通讯作者。该项研究得到了国家科技部,国家自然科学基金委,上海市科委和市教委高峰高原学科建设的资助。
原文链接: https://doi.org/10.1016/j.redox.2021.102004
撰稿人:刘敏
