该研究首次发现一组化学小分子药物可在体外及原位高效诱导扩增肌肉干细胞,成功实现老龄化和杜氏肌肉营养不良型病损肌肉组织的修复。

肌肉是人体最丰富的组成部分(约占体重的40%),对维持机体运动和生命健康至关重要。在正常情况下,如果肌肉发生损伤,位于肌纤维基底膜和质膜之间的静息状态的肌肉干细胞(亦被称为卫星细胞)会被激活,并增殖分化产生新的肌纤维,进而修复受损肌肉。尽管成人肌肉干细胞具有强大的再生潜能,然而,由于老龄化肌肉萎缩和杜氏肌营养不良症(DMD)等疾病引起的渐进性肌肉坏死,往往会导致肌肉干细胞的再生修复能力下降或者完全丧失,最终导致病人瘫痪,甚至死亡。
近年来,干细胞技术为衰老或DMD等肌肉疾病的治疗带来了巨大希望,但仍然面临一个重大的挑战是难以实现肌肉干细胞的分离、体外培养和大量扩增,从而导致肌肉干细胞的供应不足,严重限制了干细胞疗法的临床应用。
为了解决这一临床上的重大关键问题,研究团队通过筛选大量的小分子药物,首次发现forskolin(一种腺苷酸环化酶-cAMP激活剂)与 RepSox (一种选择性TGFβR-1/ALK5抑制剂)两种小分子药物组合“鸡尾酒”可选择性、高效诱导扩增皮肤来源肌肉干细胞,并发现这种小分子组合药物可同样有效诱导老年肌肉组织来源的干细胞的体外扩增(图1)。
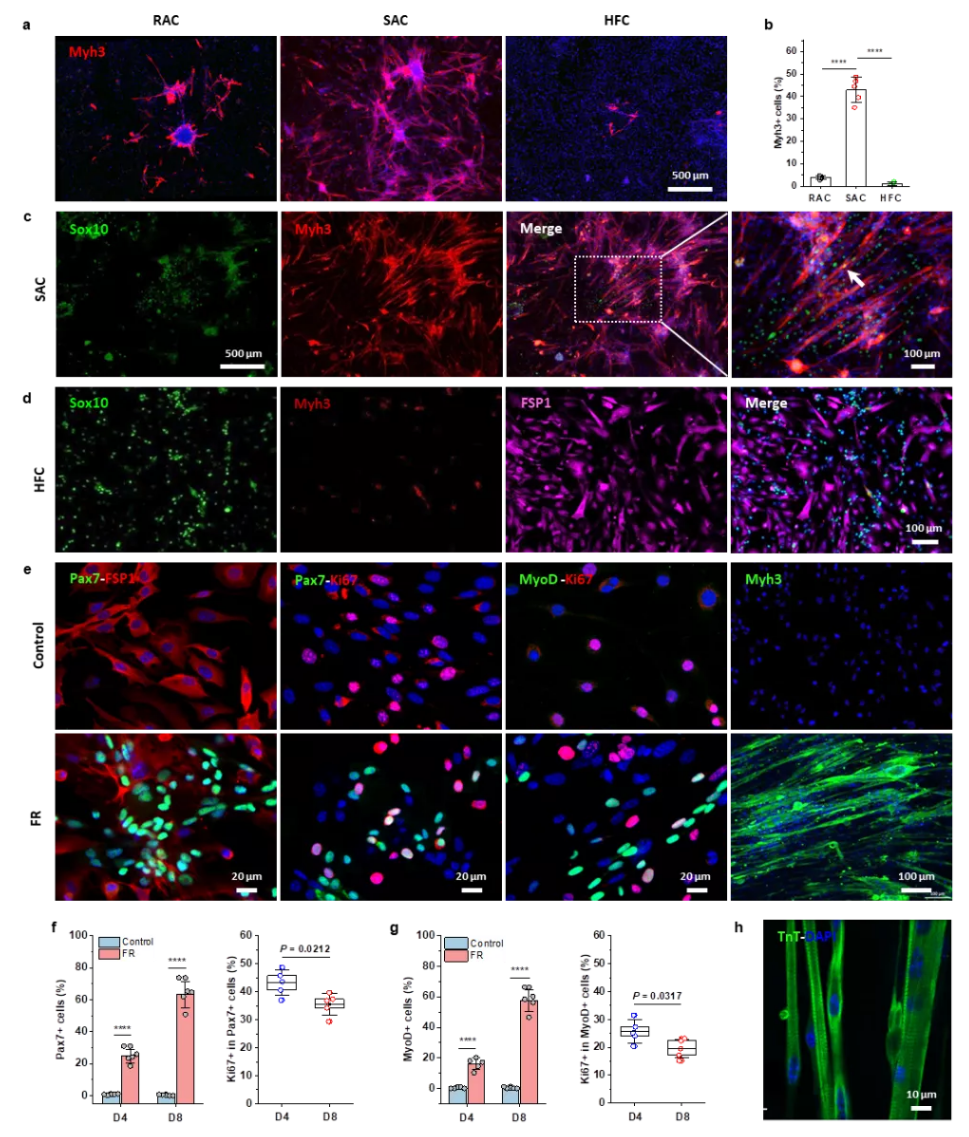
图1. 小分子药物诱导扩增皮肤来源的肌肉干细胞
研究团队进一步采用蛇毒细胞毒素(CTX)损伤的成年、老年小鼠及肌肉营养不良DMD小鼠的胫骨前肌为动物模型,开展了体外诱导干细胞注射治疗肌肉的体内实验。当把体外小分子诱导扩增的皮肤来源的肌肉干细胞注射到三种动物模型损伤肌肉中,一个月后,移植的干细胞可以生成新的肌肉纤维,并成功融合到损伤肌肉中,显著地促进肌肉的功能性修复。
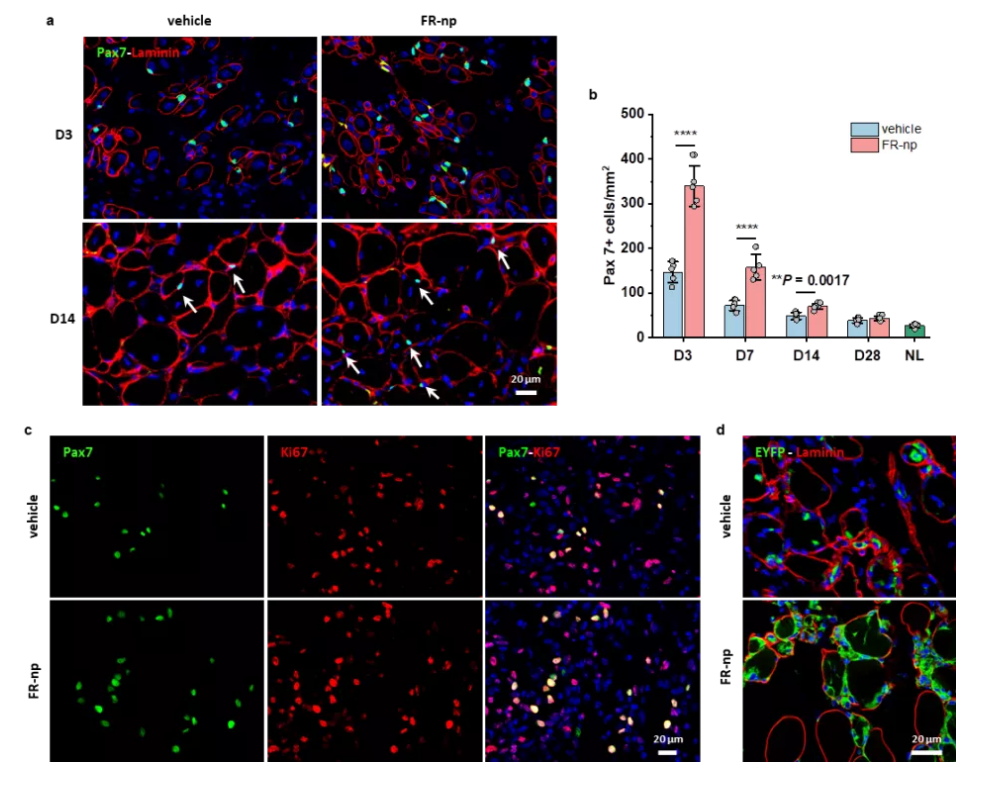
图2. 注射小分子药物体外诱导扩增皮肤来源的肌肉干细胞促进肌肉修复
接着,为了实现更加简单、便利的治疗肌肉疾病,研究团队把小分子组合药物载入生物可降解纳米颗粒,实现药物可控释放,并把载药颗粒注射到受损肌肉部位,发现可显著地刺激组织驻留的原位肌肉干细胞的扩增,成功地实现了成年小鼠和老年小鼠肌肉的原位再生修复(图3&4)。
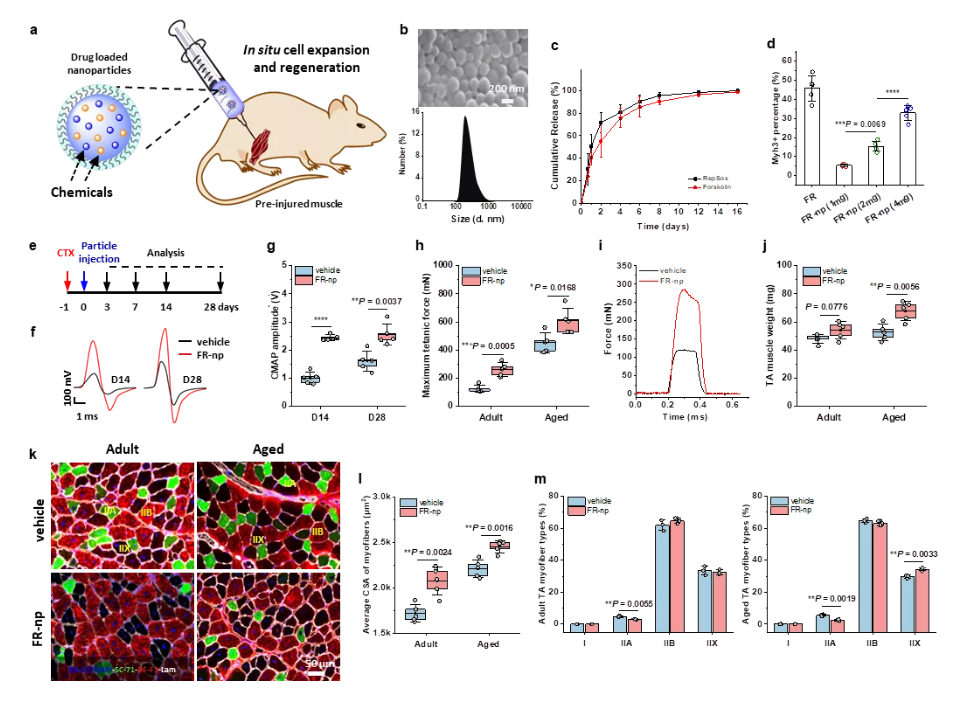
图3. 载小分子药物纳米颗粒促进肌肉修复再生
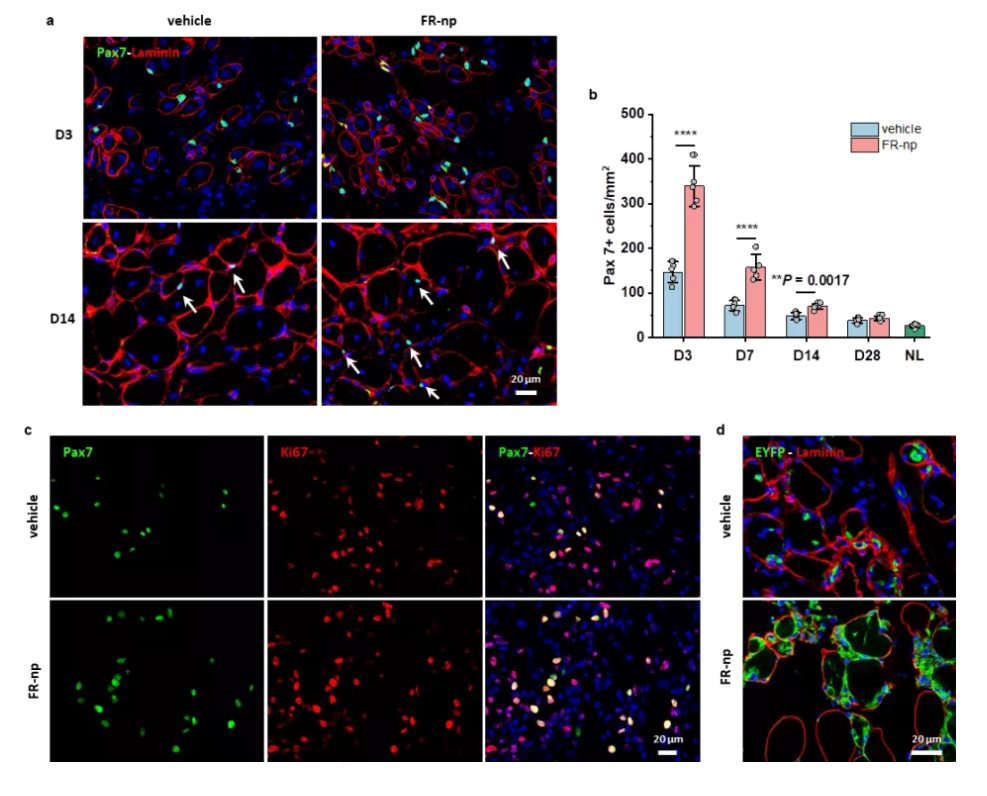
图4. 载小分子药物纳米颗粒促进原位肌肉干细胞
的增殖和肌肉修复
目前,研究团队已经在老年小鼠和DMD小鼠体内进行了小分子组合药物“鸡尾酒”体外扩增干细胞及药物递送原位治疗损伤肌肉的研究,显著地改善了受损肌肉的功能和组织再生。
下一阶段,研究人员计划开展人体实验,进一步探究细胞移植和药物递送临床治疗肌肉的效果和可行性。这一发现有望彻底解决老年性肌肉萎缩和肌肉营养不良等肌肉疾病的临床治疗难题,改善患者生存质量,具有重大的临床意义和社会意义。
加州大学洛杉矶分校生物工程系李松教授是该研究的通讯作者。李松教授是加州大学洛杉矶分校生物工程系主任。近年来主要从事细胞工程、生物材料、再生工程和免疫工程等方面的研究。方俊博士和Junren Sia 博士为本文共同第一作者。
相关论文信息:https://dx.doi.org/10.1038/s41551-021-00696-y

方俊博士目前任加州大学洛杉矶分校李松教授团队博士后、助理项目科学家;方博士将于2021年6月作为长聘教轨副教授(博士生导师)全职加入yd12300云顶线路。
方俊个人网页: https://www.junfanglab.com/
